공학이나 자연과학의 영역에서 자주 쓰이는 개념의 하나인 엔탈피를 우리는 뚜렷이 알지 못하는 경우가 있습니다. 엔탈피enthalpy는 어원이 그리스어로 안, 속을 나타내는 en과 가열하다 따듯하게하다라는 뜻을 가진 thalpo의 합성어입니다. 즉 enthalpy는 ‘내부를 따듯하게 하다’라는 의미이며 물질 내부에 포함되어 있는 열을 의미한다 하겠습니다. 그 덕에 옛날에는 열함량이라고 불리기도 하였습니다만, 열은 에너지의 이동하는 한 형태이지 저장되는 것이 아니므로 함유 또는 저장의 의미를 갖는 열함량이라는 말은 맞지 않아 더이상 쓰이지 않습니다.
엔탈피의 필요와 정의
엔탈피의 필요와 정의
엔탈피라는 물리량 개념은 열의 이동과 상태변화에 따른 물질의 에너지 변화를 나타내기 위한 열역학의 도구로서 만들어지게 되었습니다. 왜냐하면, 열역학에서 중요하게 다루는 내용은 열의 이동에 따라 변화하는 역학적 에너지의 관계를 규명하는 것이므로 이를 위해서는 물질이 보유하고 있는 에너지와 일을 수행할 수 있는 기계적 에너지를 모두 포함한 하나의 에너지 개념이 필요하게 되었기 때문입니다.
액체나 기체상태의 어떤 물질에 열이 전달된다면 물질의 내부에너지가 변화할 것이고, 그 변화는 외부로 기계적인 일을 할 수 있는 능력 즉 역학적 에너지도 변화할 것입니다. 다시 말해 내부 에너지와 역학적 에너지가 동시에 변화한다고 할 것입니다. 이를 두고 물질의 엔탈피가 변화된다고 합니다.
즉, 엔탈피란 물질이 갖는 내부 에너지와 역학적 에너지를 합친 ‘총괄적 에너지’ 개념인 것입니다. 열역학에서의 역학적(기계적) 에너지는 압력과 부피의 곱하기로 표시됩니다. 따라서 엔탈피는 수식으로
H=U+PV
H : 엔탈피
U : 내부 에너지
PV : 역학적 에너지
로 표현됩니다.
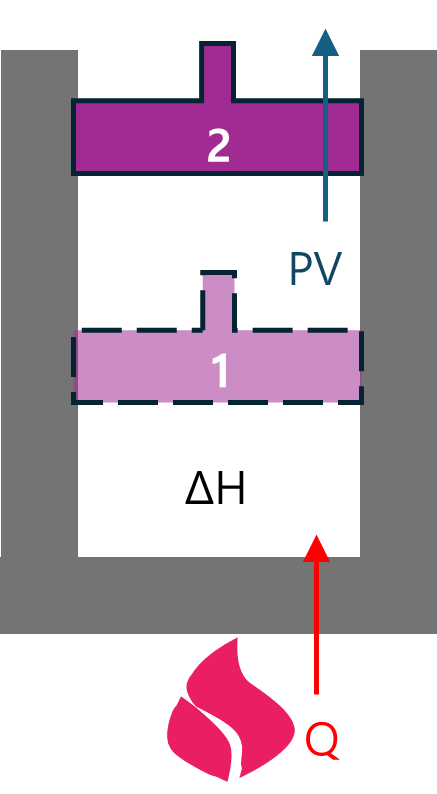
그림처럼 실린더에 열을 가해 피스톤이 1→2로 이동한 것을 열역학 제1법칙에 대입하면
ΔU=Q+(-W) (Q는 계 내부로 주어졌으므로 ‘+’ 이고, W는 계 외부로 행해졌으므로 ‘-‘)
이로서 주어진 열Q은
Q= ΔU+W
가 됩니다.
앞서 일W는 압력P와 부피V의 곱하기로 정의하였고 부피가 변하였고 압력이 일정하므로, 풀어 쓰면,
Q=(U2-U1)+P(V2-V1)
=(U2-U1)+PV2-PV1
=U2+PV2-U1-PV1
=(U2+PV2)-(U1+PV1)
=H2-H1
=ΔH
이 됩니다.
이는 주어진 열량은 계의 엔탈피 변화에 모두 사용되었다는 의미입니다. 이 예시는 부피는 변하였지만 압력은 일정한 등압과정의 예시입니다. 이와는 반대로 부피는 변하지 않고 압력이 변하는 등체적과정도 있습니다. 이 때에는 외부로 행해지는 일W이 0이 되어
Q=(U2-U1)+(P2-P1)∙0
=ΔU+0가 되며,
주어진 열은 모두 계 내부에너지의 변화에 사용되었다는 의미입니다.
피스톤의 부피가 변하는 등압과정은 기체의 ‘엔탈피’가 변하였다고 하고, 피스톤의 부피 변화가 없는 등체적과정은 '내부에너지'가 변하였다고 합니다.
약속, 물의 엔탈피 0.0J/g (@0.01℃, 0.006bar)
위에서 이야기했듯이 엔탈피는 만들어진 것이지 절대 값이 아니므로 약속한 기준값에서변화한 상대값을 결정하는데 사용됩니다. 따라서 우리는 온도 0.01℃, 압력 0.006bar일때 액체로 존재하는 물의 엔탈피를 0.0J/g으로 약속하였습니다. 이 기준 값에서부터 우리는 다음 변화한 총괄에너지의 변화인 엔탈피 변화량을 구할 수 있는 것입니다. 이는 열역학에서 해야하는 가장 중요한 계산 중 하나 입니다. 이렇게 중요한 엔탈피와 더불어 중요한 개념은 열용량이라는 개념이 있습니다.

