증기압이란 글자풀이로는 증기vapor에 의한 압력입니다. 증기상태로 존재할 수 있는 지구상의 모든 물질들은 증기압을 갖습니다. 극단적인 압력이나 온도조건을 빼고 일상에서 만날 수 있는 온도, 압력 조건에서 증기상태로 존재하지 않는 물질의 증기압은 0이 됩니다. 열역학에서 만나는 유기물질 대부분은 기체나 액체상태로 존재하므로 고유의 증기압을 갖습니다. 증기압은 어느정도 휘발성을 갖는지에 대한 휘발도의 척도가 됩니다. 일상에서 증기압이 높다는 것은 기체가 되려고 하는 성향이 큰, 다시 말해 휘발도가 크다는 의미가 됩니다. 상온 20℃에 놓인 에탄올, 물, 페놀을 예로 들어보겠습니다. 이들의 증기압은 각각 0.06bar, 0.02bar, 0.0005bar입니다. 페놀보다 물이 물보다 에탄올이 증기압이 높은 순으로 휘발성이 강한 물질입니다. 고체라고 해서 증기압이 없는 것은 아닙니다. 대기압 20℃에서 페놀은 고체이지만 기화를 하므로 증기압을 갖습니다.
삼중점
증기압을 측정하는 방법은 온도와 압력측정이 가능한 실린더에 공기와 같은 불순물이 섞이지 않도록 측정하고자 하는 물질만 넣고 실린더의 온도를 변화시키면 온도와 압력을 축으로 하는 그래프를 얻을 수 있습니다. 그 물질이 물이라고 했을 때 온도와 압력의 관계는 대략 아래 그림처럼 됩니다.
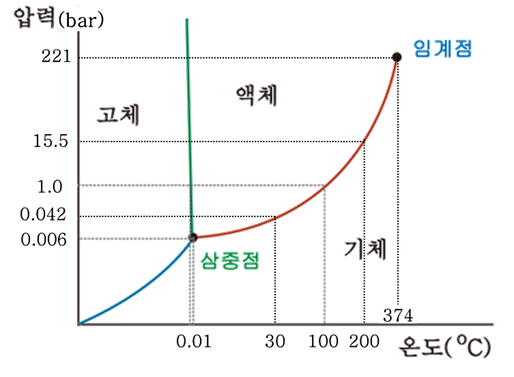
이 그림이 세로축이 바로 증기압이 됩니다. 온도가 0.01℃이면 고체인 얼음과 액체인 물, 기체인 증기가 동시에 존재하고 그중 기체가 발휘하는 증기압은 0.006bar 이며 3가지 상이 중첩되어 있어 삼중점이라고 합니다. 여기서 온도를 30℃로 높이면 증기압은 0.042bar로 상승하지만 대기압보다 낮습니다. 그러므로 30℃의 물은 대기압 하에서는 액체상태로만 있게 되고, 주변 압력이 0.042bar보다 낮으면 기체상태가 된다는 의미입니다. 물의 온도가 100℃가 되면 대기압과 같은 1bar가 됩니다. 이는 물은 100℃에서 끓는다, 비등한다 라는 의미입니다. 물이 200℃가 될 때에도 역시 증기압이 15,5bar이므로 대기압 하에서는 모두 기체상태이고 주위압력이 15.5bar보다 높다면 액체상태에 있게 됩니다.
이처럼 증기압을 이해할 때 물질이 휘발할 때 발휘되는 힘이라는 것에 더해서 물질이 고체나 액체, 또는 기체로 존재하려고 하는 경계를 나타내는 변수로 이해하면 좋을 것 같습니다. 이를 증기압은 순수한 물질의 상변화에 대한 척도라고 합니다.
임계점
만약 물이 임계점 374℃보다 높은 온도 예를 들어 390℃에 있다고 한다면 이때에는 압력을 높이더라도 액체상태로 될 수가 없습니다. 이렇게 임계점 이상의 조건에 있을 때에는 상변화가 없으므로 증기압도 없습니다. 물이 들어있는 실린더 내의 온도가 임계점을 넘어선 온도에 있다면 그 때 실린더의 압력이 낮건 높건 물의 상태가 어떠하건 그 압력을 증기압이라 부르지 않습니다.
이산화탄소를 예로 들어보겠습니다. 일상 속 대기에서 이산화탄소는 기체로 있지만, 온도를 일정하게 하고 압력을 높여가면 압축하면(등온압축) 액체로 만들 수 있습니다. 이산화탄소의 임계점은 31.1℃이므로 이 임계온도보다 낮은 온도에서 압축하면 액체로 만들 수 있습니다. 조금 더 구체적으로 대기압 하에 있는 기체상태인 25℃의 이산화탄소를 25℃를 유지하면서 64.3bar까지 높이면 이산화탄소는 액체상태로 있게 되는 것입니다. 즉, 이산화탄소의 증기압은 25℃에서 64.3bar라는 이야기입니다.
이처럼 일상에서 대기중에 기체로 있는 물질의 증기압은 매우 높습니다. 상온 대기압에서 물이 액체인 이유는 상온에서 대기압보다 물의 증기압이 낮기 때문이고, 동일한 상온 대기압에서 이산화탄소가 기체인 것은 대기압보다 이산화탄소의 증기압이 높기 때문입니다. 다시 말해 물질의 증기압이 대기압보다 높으면 기체로, 낮으면 액체로 존재하려고 하는 성향이 강하다고 할 수 있습니다.
정리
증기압은 물질의 고유 성질로 순수한 물질의 증기압은 온도만의 함수여서 일정한 온도에서는 늘 같은 값을 갖습니다. 이러한 특성으로 순수한 물질의 증기압은 온도를 측정하는 도구로도 활용됩니다. 밀폐된 용기안에 순수한 기체가 있다고 했을 때 이 기체의 압력은 온도에 비례하므로 기체 압력을 측정하면 그 온도를 알 수 있게 됩니다. 일반적인 온도계를 통해 온도를 측정할 수 없을 때 종종 사용되는 방법입니다.
물질의 증기압은 물질을 이루고 있는 분자들이 서로 인접해 있는 상태에서 떨어져 서로 멀어져 기화하고자 하는 힘을 의미합니다. 이 때문에 증기압이 크거나 작은 것은 분자간에 작용하는 인력이 작거나 크다는 것을 간접적으로 나타낸다고 할 수도 있겠습니다.
'지식 > 열역학' 카테고리의 다른 글
| 임계점 (2) | 2025.04.20 |
|---|---|
| 잠열 (0) | 2025.04.17 |
| 열용량 heat capacity (비열 specific heat) (1) | 2025.04.15 |
| 실내조건 (0) | 2025.04.14 |
| 엔탈피 enthalpy (1) | 2025.04.13 |


